아두카누맙 미국 역사상 최악의 의약품 승인
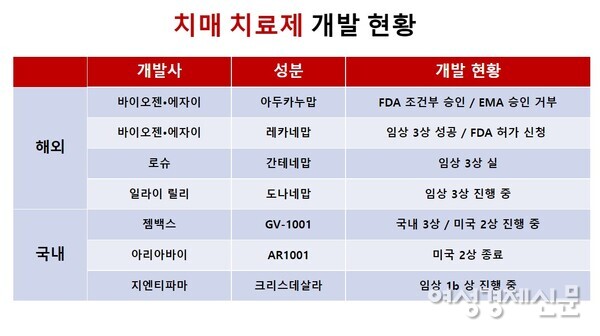
미국 제약 회사 바이오 젠의 알츠하이머 치료제 사용 승인을 둘러싸고 미국 식품 의약국(FDA)안팎이 떠들고 있습니다. 승인 결정에 반발한 FDA자문 위원 3명이 사퇴했기 때문입니다. 10일(현지 시간)CNBC에 따르면 하버드 의대의 아론·케슬하임 약학과 교수는 FDA가 바이오 젠의 알츠하이머 치매 치료제”아도우카느마브”(Aducanumab)사용을 승인한 결정이 “미국 근대 역사상 최악의 의약품 승인 건”과 자문 위원 사퇴 의사를 밝혔습니다. CNBC가 입수한 그의 서한에는 “이번 승인은 막판에 급히 『 가속 승인 』(Accelerated Approval)형태로 이루어진 “이라며”당국이 자문 위원회의 과학에 기초한 권고를 승인 결정에 제대로 반영하지 않는다는 사실이 명백했다”라고 지적되었습니다. 가속 승인과는 FDA가 의약품 사용을 승인하는 방식의 하나로 주로 암 치료제 후보 물질 승인 건에 사용됩니다. 브랜드”아듀헬무”(Aduhelm)에서 판매되는 신약은 바이오 젠과 일본 에이 사이는 공동 개발했습니다. 알츠하이머성 치매를 유발하는 것으로 알려진 베타(β)아밀로이드 단백질을 제거하는 치매의 진행 속도를 늦추고 치료제로 알려지고 있습니다. 아도우카느마브의 2회 3차 임상 시험 결과가 서로 충돌하고 FDA자문 위원회는 지난해 11월에 이미 승인을 권고하지 않는다는 결론을 내렸습니다.
1년간의 치료 과정에서 5만6000달러(약 6200만원)

FDA는 알츠하이머성 치매를 치유할 가능성이 있는 합리적인 결과가 기대할 수 있다고 최근 가속 승인했습니다. 다만 향후 임상 시험을 치르고, 다시 한번 부정적인 결과가 나오면 언제든지 승인을 철회할 수 있다는 조건을 끼쳤다. 그러나 일부 자문 위원은 이번 승인은 잘못된 판단이라고 강력히 반발하고 있습니다. 근본적인 치료약이 아니라 치매의 진행 속도를 늦추는 정도일 약인데 가속 승인까지 해야 했느냐는 것입니다. 또한 임상 시험 정보가 불안정한 것에 환자에 투여하려면 부작용의 위험이 크다는 지적입니다.CNN은 “FDA이 자문위 권고에 따라야 하는 것은 아니지만 보통 그렇게 해왔기 때문에 이번 결정은 이례적”으로 진단했습니다. FDA의 외부 전문가 자문단인 말초·중추 신경계 약물(PCNS)자문 위원회 소속 데이비드·노후망 신경과 전문의도 위원직을 사퇴하고 워싱턴 대학 신경과 전문의 요엘·펜팔 매터 박사도 사퇴서를 제출했습니다. 벌써 아도우카느마브을 처방하지 않겠다고 선언한 의사도 많습니다. 높은 아듀헬무의 가격도 논란 대상이다. 1년간의 치료 과정에 5만 6000달러(약 6200만원)이 걸립니다. 월가에서 예측한 나이 1만 2만 5000달러의 2배 이상입니다만, 바이오 젠 측은 이 가격이 합리적이라고 합니다.

메디프론치매치료제(MDR-1330) 임상추진
메디 프론(065650)가 치매 치료제 후보 물질(MDR-1330)임상을 다시 추진합니다. 미국 바이오 젠이 알츠하이머 치료제”아도우카느마브”에 대한 미국 식품 의약국(FDA)의 승인을 얻어서요. MDR-1339의 메커니즘이 아도우카느마브과 비슷하다는 점에서는 기대가 높지만, 임상 시험이 1a상에서 멈춰선 지 오랜 시간이 지난 만큼 향후 임상 시험에서 효과를 입증할 수 있을지에 대해서는 의견이 엇갈리고 있습니다.11일 관련 업계에 따르면 메디 프론은 보유한 치매 치료제 후보 물질 MDR-1339에 대한 임상 1b및 임상 2상을 내년쯤 다시 추진할 계획이라고 발표했습니다. 메디 프론 관계자는 “FDA의 아도우카느마브 승인으로 알츠하이머 치매의 치료 목적으로 베타 아밀로이드 가설이 힘을 얻게 되며 국내 임상 재개 여부뿐 아니라 다국적 제약 업체와의 파트너십을 통한 해외 임상, 라이센스 아웃 등도 검토할 수 있는 환경이 마련된 것으로 판단했다”며”내년 임상 1b와 2상을 다시 추진할 계획”이라고 합니다.https://thumbnews.nateimg.co.kr/view610///news.nateimg.co.kr/orgImg/mt/2021/06/08/mt_1623136145980_631345_0.jpg
치매는 노화로 인한 신경 퇴화, 유전적 요인, 환경적 요인에 의한 단백질 응집으로 신경 세포가 사멸하며 일어나면 알려지고 있지만 아직 정확한 원인 규명은 행해지지 않습니다. 다국적 제약사는 치매의 원인을 베타 아밀로이드(b-Amyloid, Ab)의 지나친 침착, 타우 단백질의 과잉 인산화에 의한 신경 섬유의 다발성 병변(NFT)의 생성, 염증 반응, 산화적 손상 등으로 인한 뇌세포 손상 등으로 보고 관련 기서(발증기서)의 치료제를 연구. 파이저와 존슨·앤드·존슨 바피네쥬마브, 이라이리리ー의 소라네쥬마브, 화이자의 포네쥬마브, 제임스 로슈의 쿠레 네쥬마브·세모리네마브 등이 치매 치료제 신약에 도전했지만 임상 단계에서 고배를 마셨습니다.그러나 업계는 바이 오지에은아도우카느마브이 FDA조건부 승인으로 베타 아밀로이드 억제·제거를 고리로 한 치매 치료제 개발에 희망이 생겼다고 보고 있습니다. 메디 프론도 2010년 초부터 베타 아밀로이드를 겨냥한 신약 개발에 임해 왔습니다. 치매 치료제 후보 물질 MDR-1339는 베타 아밀로이드의 응집을 억제하고 이미 섬유화된 응집을 풀어 주는 독성이 방출을 차단하고 뇌 세포 사멸을 막는 작용 기서(발증기서)을 가지고 있습니다. 메디 프론은 대웅 제약과 함께 임상 1a를 갖고 자료를 확보한 상태입니다.

일부에서는 메디 프론이 2013년 MDR-1339초기 임상 중에서 이미 8년이 지난 만큼 추가 임상에서 효과를 입증하기가 쉽지 않다고 보고 있습니다. 당시 메디 프론은 다국적 제약 회사의 임상이 실패하면서 관련 연구를 그만두었습니다. 메디 프론에 의하면, 전 임상 등에서 후보 물질에 대한 활용도와 효율을 확인했지만 당시 후보 물질과 관련된 특허 만료가 10년밖에 남지 않고 임상이 끝나면 3,4년 밖에 독점권을 유지하지 못하고 1a상에서 고용량을 투여하면서 부작용 사례가 발견됐다. 후속의 임상에서는 임상 디자인을 바꿔서 이런 문제를 해결할 방침입니다.메디 프론 관계자는 “당시 세계적으로 베타 아밀로이드에 대한 연구가 제대로 이뤄지지 않고 우리만 먼저 가는 것에 대규모 임상을 계속 진행할 수 있는지에 대한 회의가 있었다”며”바이오 젠이 임상을 진행하면서 베타 아밀로이드가 표적이 될 수 있다는 것에서 긍정적인 평가가 나오고 모험을 하더라도 임상을 다시 추진해야 한다는 결론을 내렸다”고 밝혔습니다. 이어”임상 디자인과 투여 용량 등을 모두 개선하고 내년 하반기 정도는 임상에 진입하는 것을 목표로 일련의 과정을 준비하고 있다”고 덧붙였다.
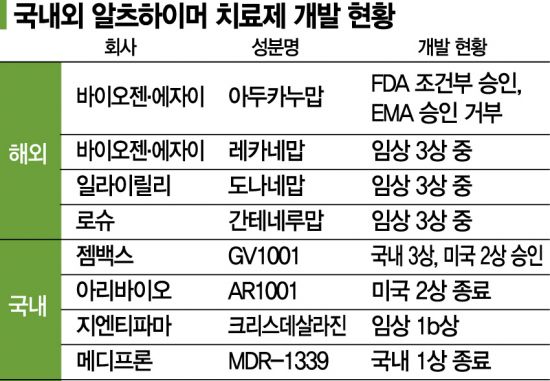
메디 프론에는 MDR-1339외에도 치매 치료제 파이프가 있습니다. MDR-066은 RAGE(Reception for Advance Glycation Endproduct)수용체가 베타 아밀로이드 단백질을 뇌 속에 전달하는 역할을 차단하는 메커니즘을 가진 후보 물질입니다. 2010년, 로시와 총액 2억 8000만달러(3200억원)규모의 기술 이전 계약을 체결했습니다. 현재 전임 장관의 단계입니다다른 치매의 원인을 공략하는 치료제도 개발 중입니다. 전남대와 3년간 공동 연구를 통해서, 타우 단백질의 과잉 인산화를 억제하고 타우 단백질의 변성과 응집을 막기 메커니즘의 선도 물질 발굴에 성공했어요. 올해는 추가 계약을 통해서 공동 연구를 계속하고 있습니다. 전남대와 NLRP3염증 조절 복합체(Inflammasome)을 겨냥하는 알츠하이머 병 치료제 개발에도 착수했습니다. NLRP3단백질 복합체를 조절하고 베타 아밀로이드와 타우 단백질 응집을 촉발하는 것을 막기 메커니즘입니다. 메디 프론은 NLRP3저해제 개발을 가속화하면서 다양한 적응증으로 확대할 수 있는 플랫폼 기술에 발전시킬 계획입니다.

뇌에좋은음식|심장마비/기억력저하/치매예방|카페인중독/부작용/하루권장량 카페인1일권장량■카페인중독:뇌를활성화시키는대표적인음료로는커피가있습니다. 앙케이트 조사에……blog.naver.com
뇌에좋은음식|심장마비/기억력저하/치매예방|카페인중독/부작용/하루권장량 카페인1일권장량■카페인중독:뇌를활성화시키는대표적인음료로는커피가있습니다. 앙케이트 조사에……blog.naver.com

뇌에좋은음식|심장마비/기억력저하/치매예방|카페인중독/부작용/하루권장량 카페인1일권장량■카페인중독:뇌를활성화시키는대표적인음료로는커피가있습니다. 앙케이트 조사에……blog.naver.com
